(1)概念:由形成的物質,是連結物質化學性質最小的微粒,化學變化中可分。
(銅生銅綠的前提:銅與、水、接觸。銅綠的化學式:)
b.燃料與空氣有足夠大的接觸面積。
單質:金屬、罕見氣體及大大都固態非金屬凡是用元素符號暗示它們的化學式;而氧氣、氫氣、氮氣等非金屬氣體的由兩個原子形成,其化學式暗示爲、、。
钛合金:熔點高、密度、機械機能好、耐侵蝕性強、“相溶性”等
(3)無定形碳:由石墨的細小晶體和少量雜質形成.次要有:焦炭,柴炭,活性炭,炭黑等。
c.降溫到著火點以下
1.物質
(2)質子數決定元素品種。
(CO32-的查驗:先加鹽酸,然後將發生的氣體通入石灰水。)
.化學嘗試根基操作
4)驗證方式:將制得的氣體通入的石灰水,如能變混濁,則是二氧化碳。
(3)影響燃燒現象的要素:可燃物的性質、氧氣的濃度、與氧氣的接觸面積
(1)鐵的冶煉
第五單位:化學方程式
c.催化劑(觸媒):在化學反映中能改變其他物質的化學反映速度,而本身的質量和化學性質在反映前後都沒有發生變化的物質。(一變兩不變)。
(4)化學反映中的能量變化CaO+H2O=Ca(OH)2放熱反映
(2)滅火的道理:(只需消弭燃燒前提的肆意一個即可)
(1)金屬的越靠前,它的勾當性就越強
3.離子
、化石燃料
(4)結論:約占空氣體積的1/5。.
金屬資本的和操縱
CO2+Ca(OH)2==CaCO3↓+H2O
用于查驗二氧化碳
鐵在氧氣中燃燒燒集氣瓶中放少量水或細砂的目標:防止濺落的高溫熔化物炸裂瓶底。
測定方式和道理(電解水)
.根基反映類型
(2)化學式
使燃料充實燃燒的兩個前提:
燃燒和滅火
(2)石墨(C)是最軟的礦物之一,有優秀的導電性,潤滑性。可用于制鉛筆芯、幹電池的電極、電車的滑塊等。
化合價和化學式
(2)氧氣的制備:
化學性質可燃性
b.防止鐵成品生鏽的辦法:
1.構成:N278%、O221%、罕見氣體、CO2其它氣體與雜質0.03%。
(1)常溫下的不變性。
和的燃燒火焰是:發出淡藍色的火焰。
(3)罕見氣體(、、、、等的總稱):氣、電光源(通電發分歧顔色的光)、激光手藝。
(3)元素的化學性質與原子最外層電子數親近相關。
3)氣體收集方式:向上排空氣法
(現象:紅棕色粉末逐步變成黑色,石灰水變混濁。)
和的化學性質有很大差別的緣由是:的形成分歧。
(1)概念:原子是化學變化中的最小微粒,化學變化中不成分。(2)三個根基性質(一小二動三間隔)。
CaCO3+2HCl==CaCl2+H2O+CO2↑
影響要素(溫度、壓強)。
(置換反映)使用:冶金工業
(3)化學方程式相關計較。
(前提:“前換後,鹽可溶”)
(1)用于加熱的儀器--試管、燒杯、蒸發皿、燃燒匙。
(2)有毒:吸進肺裏與血液中的血紅卵白連系,使人體貧乏氧氣而中毒。
乙醇俗稱酒精化學式
(3)金屬+鹽→另一金屬+另一鹽
金屬的化學性質
c.化合物中各元素正、負化合價的代數和爲零,單質中元素化合價爲零。
既操縱其物質,又操縱其化學性質
(1)氧氣:帶火星的木條。
(1)金剛石(C)是天然界中最硬的物質,可用于制鑽石、刻劃玻璃、鑽探機的鑽甲等。
第七單位燃料及使用
第四單位:天然界的水
(2)鐵的鏽蝕
原子
(2)二氧化碳的工業制法:
(2)位于氫前的金屬能置換出鹽酸、稀硫酸中的氫(不成用濃硫酸、硝酸)
支撐燃燒(如燃料燃燒、煉鋼、氣焊)。
教員的微信號:ziluolanzz
高溫(吸熱反映)
化學變化:生成了其它物質的變。
(3)氫氣:將氣體點燃,用幹冷的燒杯罩在火焰上方;或者,先通過灼熱的氧化銅,再通過無水硫酸銅。
第八單位金屬和金屬材
活性炭感化:吸附(色素和異味)。
CH4+2O2點燃CO2+2H2O(藍色火焰)
?硫在氧氣中燃燒集氣瓶中放入少量水的目標:接收,防止其汙染空氣。
(2)化學性質:
b.制取氧氣的操作步調(以高錳酸鉀制取氧氣並用排水法收集爲例)
一般環境下不克不及燃燒,也不支撐燃燒,不克不及供給呼吸
現象:黑色粉末逐步變成亮光紅色,石灰水變混濁。
①化合反映:由兩種或兩種以上物質生成另一種物質的反映。
(1)物質:無色,無味的氣體,密度比空氣大,能溶于水,高壓低溫下可得固體—-幹冰
(1)概念:具有不異核電荷數(質子數)的一類原子的總稱。
和的燃燒火焰是:發出藍色的火焰。
金剛石和石墨的物質有很大差別的緣由是:碳原子的陳列分歧。
c.推進農業成長
現象:黑色的氧化銅逐步變成亮光紅色,石灰水變混濁。
(5)分手物質及加液的儀器--漏鬥、長頸漏鬥、分液漏鬥。
不克不及,緣由:産品是氣體,不克不及發生壓強差。
1)道理:用石灰石和稀鹽酸反映:
注:最外層電子數不異其化學性質不必然都不異(Mg,He最外層電子數爲2)。
核電荷數=質子數=核外電子數=原子序數
申明:
在金屬勾當性挨次裏:
初中化學微信:chuzhonghuaxue100
2)與水反映生成碳酸:CO2+H2O==H2CO3
(1)物質:無色,無味的氣體,密度比空氣略小,難溶于水。
(1)水的構成
常見的鐵礦石:磁鐵礦(次要成分是)、赤鐵礦(次要成分是)
③要考慮空氣中的物質能否加入反映或物質(如氣體)有無脫漏。
夾雜物:由兩種或兩種以上物構成,各物質都連結本來的性質。
第六單位碳和碳的氧化物
(1)二氧化碳的嘗試室制法
(3)稱量器--托盤天平(左物右碼)。
完全燃燒(氧氣充沛),生成CO2:
(“濕法冶金”道理)
化合物:由分歧種元素構成的物。
②可否用鐵、鎂取代紅磷?
生石灰和水反映可得熟石灰:CaO+H2O=Ca(OH)2
1.水
幹冰用于人工降雨、制冷劑
節約化石燃料
a.常溫下一般爲固態(汞爲液態),有金屬光澤。
.物質:不需要發生化學變化就表示出來的性質,如:顔色、形態、密度、氣息、熔點、沸點、硬度、水溶性等。
(2)氮氣:氣(化性不活躍)、主要原料(硝酸、化肥)、液氮冷凍。
二氧化碳的性質
第二單位:空氣
:個亞鐵離子。
(3)形成:原子核(質子〔+〕、中子)和核外電子〔-〕。
(2)二氧化碳:的石灰水。
高溫

(2)乙醇汽油-汽油中插手適量的乙醇
留意:查驗CaO能否含CaCO3加鹽酸:
和的燃燒火焰是:發出敞亮的藍色火焰。
道理:Na2322↑
沈澱——過濾——吸附——消毒。
單質碳的化學性質
物質分類
a.消弭可燃物b.氧氣(或空氣)
(4)加熱器皿--酒精燈。
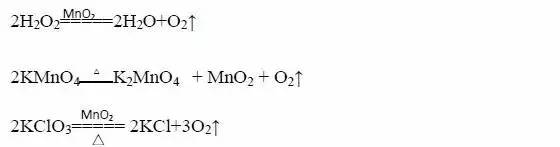
③置換反映:一種單質和一種化合物反映,生成另一種單質和另一種化合物的反映。
②分化反映:由一種反映物生成兩種或兩種以上其他物質的反映。
③制成不鏽鋼
元素
△Cu+CO2
2.空氣中氧氣的測定道理:壓強差
(2)自來水的淨化過程和淨化道理
化學性質可燃性
(2)三個根基性質(一小二動三間隔)
氧化物:由兩種元素構成的化合物中,此中有一種元素是氧元素。
不完全燃燒(氧氣不充沛),生成CO:
單質:由同種元素構成的物。
優良文章保舉
高溫
質量守恒定律
(1)氧氣的化學性質:支撐燃燒,供給呼吸。
a.削減汙染
計較物質構成元素的質量比:相對原子質量×原子個數之比。
(1)金屬的物質:
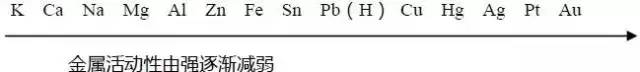
初中化學
(1)概念:帶電的原子或原子團。
(2)安裝要求:氣密性優良操作要求:冷卻到室溫後打開彈簧夾。
第三單位物質形成的奧妙
3)能使的石灰水變混濁:
②不加入反映的物質質量及不是生成物的物質質量不克不及計入“總和”中。
.化學性質:物質在化學變化中表示出來的性質,如:可燃性、助燃性、氧化性、還原性、酸堿性、不變性等。
相對原子質量≈質子數+中子數
b.大大都呈雪白色(銅爲紫紅色,金爲)
(2)可燃性:
(3)位于前面的金屬能把位于後面的金屬從它們的鹽溶液中置換出來。(除、、)
①質量守恒定律只合用于化學變化,不合用于物理變化。
CaCO3+2HCl==CaCl2+H2O+CO2↑
b.幾種數字的寄義
通過灼熱的氧化銅
.物理變化:沒有生成其它物質的變化。
長處:
(1)三大化石燃料:煤、石油、天然氣(次要成分甲烷)
①連結鐵成品概況的潔淨、幹燥
a.可燃物b.氧氣(或空氣)c.溫度達到著火點
甲烷的化學式(最簡單的無機物,相對證量最小的無機物)
(1)可燃物要求:足量且産品是固體,紅磷。
(5)探究:
不克不及,緣由:鐵不克不及在空氣中燃燒,鎂會與2、2反映。
常見氣體的用處:
4)與灼熱的碳反映:
除雜:CO[CO2]通入石灰水或氫氧化鈉溶液:
高溫4Fe+3CO2↑
(2)合金:由一種金屬跟其他一種或幾種金屬(或金屬與非金屬)一路熔合而成的具有金屬特征的物質.
(2)金屬+酸→鹽+↑
(1)燃燒的前提:(缺一不成)
查—裝—定—點—收—離—熄。
.常用儀器及利用方式
碳的幾種單質
①寫法:
物質無色無味的氣體密度比空氣小極難溶于水。
(1)大大都金屬可與氧氣的反映
(1)氧氣:供呼吸(如潛水、醫療急救)。
①液面上升小于1/5緣由:安裝漏氣,紅磷量不足,未冷卻完全。
只能煅燒(不成加鹽酸)
一氧化碳

煅燒石灰石:CaCO3高溫CaO+CO2↑
點燃2CO
(2)緣由(變-原子品種、數目、質量反映前後不變)。
.常見氣體的查驗方式
單質碳的物質各別,而各類單質碳的化學性質卻不異!
第一單位:走進化學世界
計較相對證量各元素的相對原子質量×原子個數之和。
(3)新能源:氫能源(最潔淨的能源)、太陽能、核能、風能、地熱能、潮汐能
生成的碳酸能使紫色的石蕊試液變紅,
高溫CaO+CO2↑
②意義:如化學式的意義:點,化學式的意義:點。
(1)概念(反映物和生成物前後質量不變)。
c.計較物質中某元素的質量分數。
道理:在高溫下,操縱焦炭與氧氣反映生成的一氧化碳把鐵從鐵礦石裏還原出來。
a.鐵生鏽的前提是:鐵與、水接觸(鐵鏽的次要成分:)
(3)現象:放熱,有大量白煙發生,打開彈簧夾後,廣口瓶內液面上升約體積。
(3)化學性質:(H2、CO、C具有類似的化學性質:①可燃性②還原性)
1)可燃性:2CO+O2點燃2CO2(可燃性氣體點燃前必然要查驗純度)
區分硬、軟水方式:番笕水。
鐵合金——生鐵和鋼:次要成份都是鐵,但含碳量分歧
a.要有足夠多的空氣
(3)還原性:高溫2Cu+CO2↑
C2H5OH+3O2點燃2CO2+3H2O
(2)測容器--量筒(視線與量筒內液體凹液面的最低點連結程度)。
②概況塗膜:如塗油、刷漆、電鍍等
③計較:
H2CO3==H2O+CO2↑碳酸不不變,易分化
2)還原性:△使用:冶金工業
3.氧氣的性質和制備
選用固液不加熱安裝
(3)用處:滅火
辨別:H2、CO、CH4可燃性的氣體:看燃燒産品(不成按照火焰顔色)
③可否用碳、硫取代紅磷?
最外層電子數分歧其化學性質有可能類似(He,Ne均爲不變布局)。
結論:水是由氫氧元素構成的,H2(負極)與O2(正極)的體積比爲2:1,質量比爲1:8。
工業制氧氣——分手液態空氣法(道理:液氮和液氧的沸點分歧物理變化)
每個亞鐵離子帶兩個單元正電荷。
常見金屬勾當性挨次:
點燃
驗滿方式:用點燃的木條,放在集氣瓶口,木條熄滅。則已集滿二氧化碳
(1)化合價
物:由一種物質構成。
二氧化碳的制法
c.有優良的導熱性、導電性、延展性
(2)暗示方式及意義:如:一個鐵離子帶個單元正電荷。
原料:鐵礦石、焦炭、石灰石、空氣
a.寫法及意義:MgCl2:氯化鎂中鎂元素化合價爲+2價。
化合物:正價在前,負價在後(、CH4除外)。
嘗試室制氧氣道理